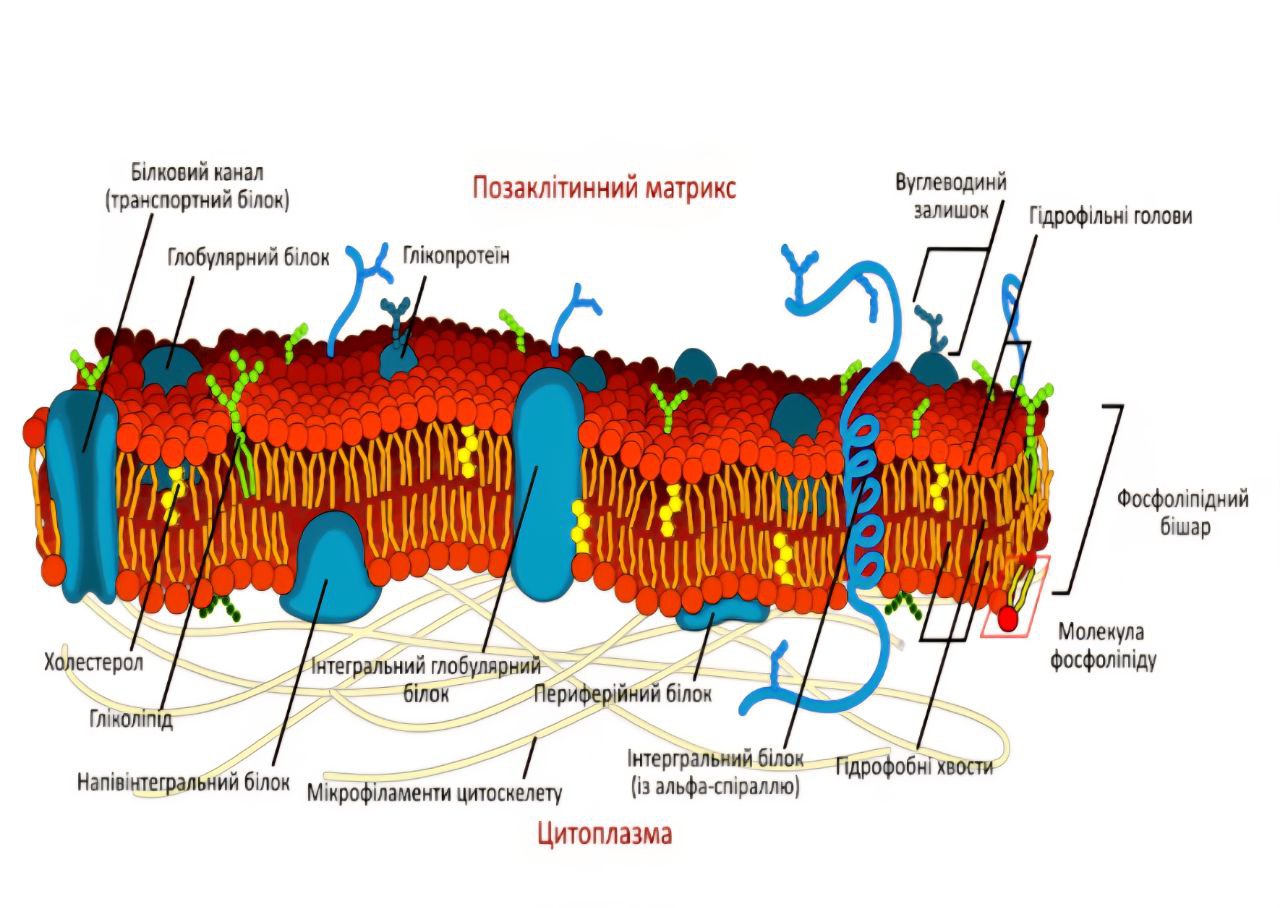
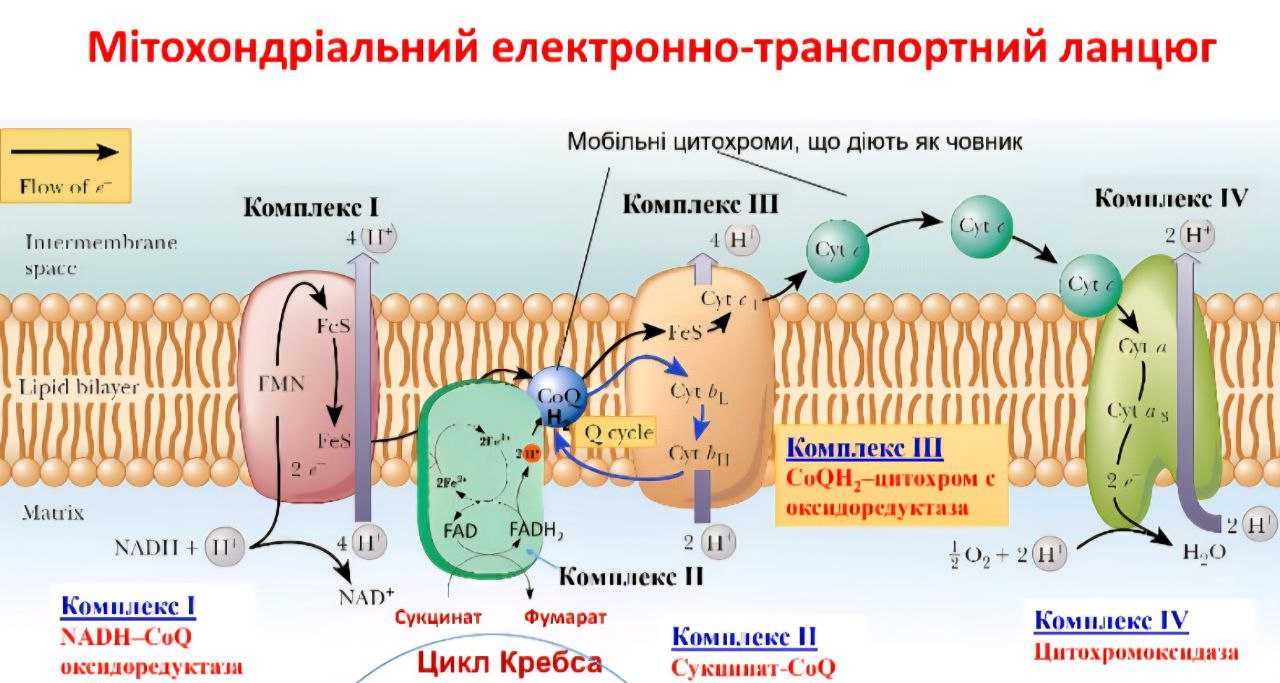
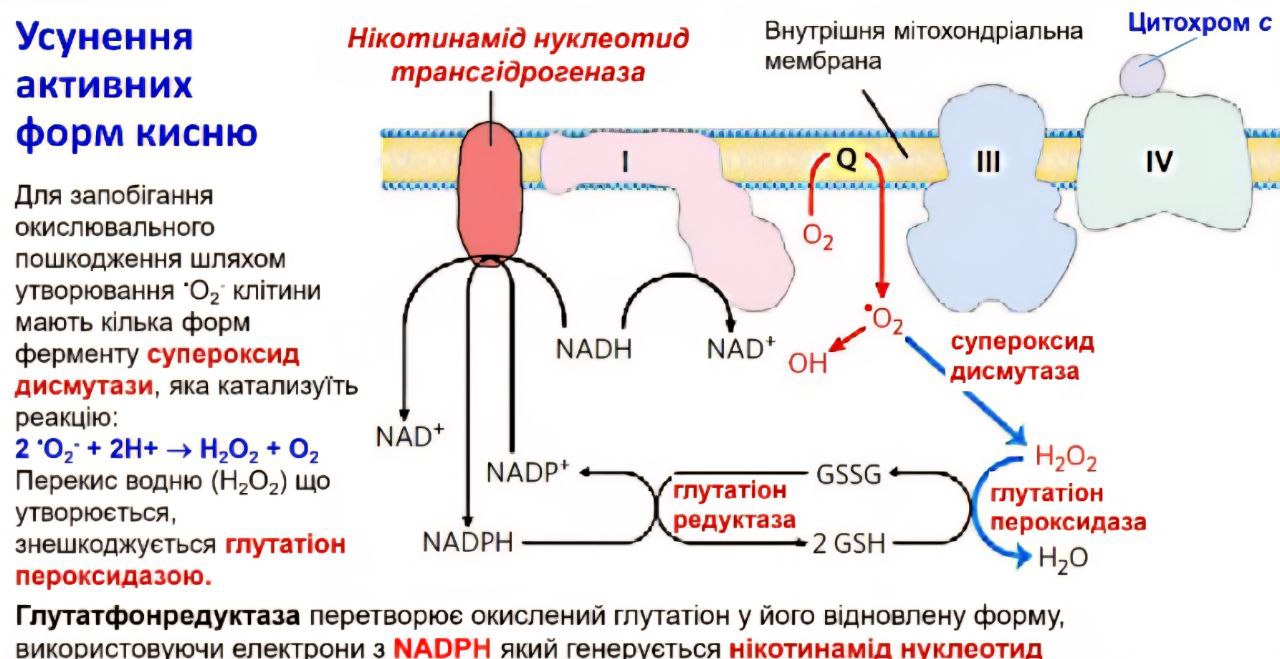
Роль RONS у Клітинному Очищенні та Ядерній Активації
Переходячи до механізму клітинного очищення, варто розглянути активацію автофагії та участь лізосом. Після маркування пошкоджених органел утворюється аутофагосома, що зливається з лізосомою — органелою, багатою ферментами для деградації. Метаболітно-індукований оксидативний сигнал активує ключові регулятори автофагії — AMPK і Beclin-1, які ініціюють утворення аутофагічної мембрани. Лізосома, у свою чергу, активується завдяки підвищенню експресії протонних помп (V-ATPase), що знижує її pH і робить ферменти максимально активними. Таким чином, RONS слугують тригером контрольованої аутофагії, у ході якої клітина позбавляється не лише дефектних мітохондрій, а й інших пошкоджених структур, забезпечуючи внутрішнє «прибирання» і омолодження цитоплазми.
А тепер з’ясуємо, що відбувається з ядром під час дії продуктів іонізації газів, а саме — як активуються гени регенерації. Коли концентрація RONS досягає певного горметичного порогу, у цитоплазмі відбувається окислення цистеїнових залишків інгібітора KEAP, що звільняє транскрипційний фактор Nrf2. Nrf2 мігрує в ядро і зв’язується з елементами антиоксидантної відповіді (ARE), активуючи експресію генів, що кодують ферменти антиоксидантного захисту (HO-1, SOD, GPx) та репарації ДНК. Кінцевий результат: посилення внутрішнього захисту, стимуляція синтезу білків відновлення і проліферації клітин, що створює молекулярну основу для регенерації тканин після контрольованого плазмового впливу.
Роль Електромагнітного Поля та Фінальний Висновок
Крім хімічних метаболітів, важливу роль відіграє електромагнітне поле плазми. Окрім хімічних метаболітів, плазма генерує низькоамплітудне електромагнітне поле, яке впливає на потенціал мембрани клітини. Завдяки цьому активуються іонні канали (особливо кальцієві), що призводить до короткочасного підвищення внутрішньоклітинного Ca2+ — потужного сигналу для екзоцитозу, міграції, диференціації та ремоделювання цитоскелета. Цей ефект підсилює RONS - залежні сигнальні каскади та може сприяти включенню програм проліферації і відновлення тканини.
Таким чином, підсумовуючи, плазмові метаболіти діють не лише як окисники, а як сигнальні молекули регенерації. У контрольованій дозі вони:
- підвищують проникність мембран і запускають захисні сигнали;
- стимулюють мітофагію та автофагію;
- активують транскрипційні фактори відновлення (Nrf2);
- гармонізують іонний обмін через вплив електромагнітного поля.
Ці механізми створюють умови для самоочищення, відновлення та омолодження клітини, що робить холодну атмосферну плазму перспективним інструментом у боротьбі зі старінням на клітинному рівні.
Апоптоз, Аутофагія та Гомеостаз: Плазма як Регулятор Життєвого Циклу Клітини
Переходячи до філософії клітинного життя, розглянемо клітинний гомеостаз як динамічну рівновагу. Кожна клітина перебуває у стані постійного балансу між синтезом і деградацією, пошкодженням і відновленням, життям і загибеллю.
Ця динамічна рівновага визначається координацією трьох основних процесів:
- автофагії — внутрішнього очищення від дефектних компонентів;
- апоптозу — програмованої загибелі без запалення;
- регенерації — заміщення клітин, що завершили свій життєвий цикл.
Порушення цієї тріади, зокрема пригнічення автофагії чи дефектність апоптозу, веде до накопичення нефункціональних клітин і органел, що є центральним патогенетичним механізмом старіння.
Аутофагія та Апоптоз: Динамічний Баланс, Регульований Плазмою
Почнемо з розгляду аутофагії — ключового механізму відновлення гомеостазу. Аутофагія — це контрольований процес, за допомогою якого клітина утилізує пошкоджені або старі білки й органели, розщеплюючи їх у лізосомах. Вона активується при енергетичному дефіциті, окисному стресі чи механічному пошкодженні. Під дією RONS, створених холодною плазмою, відбувається помірна активація AMPK (енергетичного сенсора клітини) і пригнічення mTOR, що запускає каскад утворення аутофагосом. Цей процес не є руйнівним — навпаки, він забезпечує вибіркове видалення дефектних структур і оновлення цитоплазми, запобігаючи апоптозу. Після завершення очищення клітина відновлює енергетичну стабільність і переходить у стан функціонального оновлення, що є основою її довготривалого виживання.
Далі розглянемо апоптоз — природний механізм клітинного «відбору». Коли пошкодження клітини стає незворотним, вмикається програма апоптозу — безпечної самознищувальної реакції. Апоптоз контролюється мітохондріями: вивільнення цитохрому c призводить до активації каспаз-9, -3, -7, які розщеплюють білковий каркас клітини, не викликаючи запалення.
Процес апоптозу, або програмованої загибелі клітин, може бути ініційований внутрішнім (мітохондріально-опосередкованим) шляхом утворення пір у зовнішній мембрані мітохондрій. Ці пори дозволяють цитохрому c залишити міжмембранний простір і увійти в цитозоль. Потрапивши в цитозоль, цитохром c, у поєднанні з проапоптотичними факторами, активує сімейство протеолітичних ферментів (каспаз), викликаючи розщеплення ключових білків і призводячи до морфологічних та біохімічних змін, характерних для апоптозу.
Слід підкреслити, що холодна атмосферна плазма в помірних дозах не викликає масового апоптозу, але може селективно ініціювати загибель клітин, що втратили контроль за поділом або мають критичні пошкодження ДНК. Це особливо важливо у контексті онкопревенції та відновлення тканинної гомеостазії, де плазма допомагає «прибрати» клітини, що загрожують системі. Таким чином, плазмові метаболіти діють як сигнальний фільтр, сприяючи виживанню здорових клітин і елімінуючи дефектні.
Регуляція Життєвого Циклу Клітини Плазмою
Розглянемо, як відбувається координація між автофагією й апоптозом. Обидва процеси — автофагія та апоптоз — тісно взаємопов’язані. RONS можуть виступати регуляторними молекулами, які визначають напрямок реакції: при низьких концентраціях вони стимулюють ремонт і очищення (через Nrf2, AMPK, PINK1/Parkin), а при високих — вмикають програму загибелі (через JNK, p53, каспази). Тобто, дія плазми залежить від дози і тривалості експозиції: короткочасний імпульс викликає «м’який стрес» і стимулює регенерацію, а надлишковий вплив — загибель клітин, що вийшли з-під контролю.
Виходячи з цього, технологія іонізації газів виконує гомеостатичну функцію. Холодна атмосферна плазма у контрольованих параметрах діє як фізіологічний регулятор, а не руйнівний агент. Вона створює тимчасову, дозовану нестабільність, яка мобілізує клітинні механізми саморегуляції:
- RONS виступають тригерами адаптивних реакцій і очищення;
- електричне поле плазми — стимулятор іонного обміну й внутрішньоклітинної сигналізації;
- короткі імпульси — фактори горметичного тренування, що підвищують стійкість клітин до майбутніх стресів.
У результаті клітина не лише відновлює структуру, а й оновлює програму виживання, що підвищує тривалість її функціонального життя.
І наостанок, зробимо висновок. Життя клітини — це безперервний цикл народження, роботи, очищення й завершення. З віком у цій системі зменшується ефективність фільтрації дефектних структур, і саме тут контрольоване плазмове втручання може повернути рівновагу. Холодна атмосферна плазма, завдяки поєднанню RONS і електромагнітного поля, відновлює клітинний контроль якості, запускає автофагію та мітофагію, сприяє вибірковому апоптозу зламаних клітин, і реактивує сигнальні шляхи регенерації (Nrf2, PI3K/Akt, MAPK).
Плазмова Терапія як Стратегія Антивікового Втручання
Таким чином, технологія іонізації газів не лише впливає на окремі клітини — вона підтримує гомеостаз у масштабі тканини, допомагаючи організму зберігати молодість, адаптивність і структурну цілісність.
Переходячи до практичного застосування, розглянемо біологічну логіку плазмового втручання. Старіння — це не лише накопичення ушкоджень, а й втрата ефективності механізмів самовідновлення. Плазмова терапія впливає саме на ці механізми, виступаючи м’яким стимулятором клітинного «ремонту». Її дія не зводиться до антибактеріального ефекту чи поверхневої коагуляції: вона проникає у глибину клітинних процесів, модулюючи редокс-сигналізацію, мітофагію, автофагію та генно-транскрипційні відповіді. Контрольоване введення RONS створює горметичний стимул — короткочасний окислювальний стрес, який активує адаптивні системи без руйнівного ефекту. Таким чином, клітина отримує «сигнал тренування», що підвищує її стійкість до подальших стресів і відновлює внутрішню рівновагу.
Розкриємо детальніше молекулярні шляхи, задіяні в антивіковій дії ТІГ. Завдяки плазмовому втручанню відбуваються такі процеси:
- Активується шлях Nrf2/KEAP1/ARE →, що призводить до підвищення експресії антиоксидантних ферментів (HO-1, NQO1, GPx, SOD), посилюючи цитопротекцію.
- Стимулюється AMPK і інгібування mTOR →, запускаючи автофагію та очищення клітини від дефектних органел.
- Запускається PINK1/Parkin- залежна мітофагія, що забезпечує вибіркове видалення пошкоджених мітохондрій.
- Відбувається помірна активація p53 і FOXO3a →, що сприяє відновленню балансу між репарацією та апоптозом.
- Посилюється синтез колагену та факторів росту (TGF-β, VEGF) — це пряма реакція на легке мембранне подразнення та локальний Ca²⁺ - сигнал.
Завдяки цим механізмам, холодна плазма, а саме технологія іонізації газів Plasma Skin, діє системно, стимулюючи регенерацію, підвищення клітинної енергії та оновлення тканинного матриксу.
І тепер перейдемо до клінічних проявів антивікового ефекту.
На тканинному рівні, особливо в дермі, плазмові метаболіти спричиняють низку позитивних змін:
- Поліпшення мікроциркуляції та оксигенації через NO- опосередковану вазодилатацію.
- Підвищення проліферації фібробластів і стимуляція синтезу колагену I та III типу.
- Зменшення хронічного запалення через зниження рівня NF-κB і цитокінів IL-6, TNF-α.
- Прискорення загоєння мікропошкоджень і оновлення позаклітинного матриксу.
- Збільшення еластичності й тургору шкіри за рахунок ремоделювання колагеново-еластинової мережі.
Крім того, важливо відзначити, що у поєднанні з косметичними чи фармакологічними протоколами, плазмова стимуляція підвищує чутливість клітин до біоактивних речовин, сприяючи глибшому засвоєнню пептидів, вітамінів та антиоксидантів.
Контрольоване Дозування як Ключ до Безпеки
Критичним фактором, що визначає ефект, є контрольоване дозування. Біологічний ефект плазмової експозиції є дозозалежним. Надмірна експозиція або висока енергія призводять до цитотоксичності, тоді як помірна стимуляція викликає «корисний стрес» (eustress), який тренує клітину.
Основними параметрами, які слід контролювати, є:
- склад газової суміші (He, Ar, O₂, N₂);
- потужність і частота імпульсів;
- відстань до поверхні тканини;
Тільки коротке дозування забезпечує горметичне «вікно користі», у якому плазма працює як регенератор, а не як деструктор. Наприклад, у роботі з технологіями Plasma Skin рекомендований час експозиції складає 10-15 хвилин на площу 10 кв. см.
Системна Дія через Міжклітинну Сигналізацію
І наостанок, варто розглянути системну дію через міжклітинну сигналізацію. Дослідження показують, що після плазмового впливу клітини вивільняють екзосоми, збагачені антиоксидантними білками, мікроРНК і факторами росту. Ці наночастинки діють на сусідні клітини, передаючи сигнал відновлення — феномен, який можна розглядати як «регенераційний ланцюг». Отже, навіть локальне плазмове втручання може викликати системну реакцію омолодження через комунікаційні мережі тканин.
Формула Дії Плазмових Метаболітів та Потенціал Довголіття
Почнімо з принципової логіки плазмового впливу. У біологічних системах довголіття не є просто відсутністю руйнування, а є здатністю підтримувати гомеостаз у змінних умовах. Кожна клітина, тканина і орган працюють у межах постійного обміну енергії, сигналів і речовин. Коли ця взаємодія порушується — накопичуються дефектні органели, фрагменти білків, надлишкові ROS — система переходить у стан хронічного стресу і прискореного старіння. Холодна атмосферна плазма (ХАП) є унікальним інструментом, який здатен керовано втрутитися в цей цикл, діючи не руйнівно, а біомодулююче: вона створює короткий, дозований стрес, що стимулює самоочищення, адаптацію і оновлення клітин.
Три Рівні Плазмового Регулювання
Цей біомодулюючий вплив реалізується на трьох ключових рівнях, які забезпечують системну регенерацію.
- Молекулярний рівень:
RONS модифікують сірковмісні залишки білків (Cys, Met), що активує сигнальні каскади Nrf2, AMPK, MAPK. Відбувається редокс-переналаштування клітини: посилення антиоксидантних систем, репарації ДНК, синтезу білків теплового шоку.
- Органелярний рівень:
Активація автофагії та мітофагії призводить до очищення енергетичних систем. Мітохондрії омолоджуються, відновлюють Δψ_m і ефективність ОФ; лізосоми підвищують активність V-АТФази та ферментів. Як наслідок, знижується базальний рівень ROS і запалення.
- Тканинний рівень:
Через виділення екзосом і цитокінів регенерації ((VEGF, TGF-β, EGF) формується сигнал відновлення. Поліпшується міжклітинна комунікація, мікроциркуляція й оксигенація. Регенеративна відповідь поширюється каскадно, навіть за межі зони впливу.
Плазма як «М’який Еволюційний Відбір»
Таким чином, у цій моделі Холодна плазма у вигляді технології іонізації газів виступає своєрідним селективним біофільтром:
Вона підтримує життєздатні клітини, які здатні адаптуватися, і усуває ті, що втратили метаболічний контроль. Фактично, цей процес імітує природну еволюційну логіку на клітинному рівні — «виживання функціонально найпридатніших». Така вибірковість забезпечує оновлення тканин без пошкодження структурної цілісності, що є фундаментом довготривалого омолодження.
Координація Ефектів та Гормезис
Крім того, роль електромагнітного поля у координації ефектів є незамінною. Плазма створює динамічне електромагнітне середовище, у якому коливання потенціалів на клітинній мембрані стимулюють:
- відкриття кальцієвих каналів,
- активацію сигнальних шляхів PLC/IP₃/Ca²⁺,
- ремоделювання цитоскелета та міжклітинних контактів.
Цей ефект синергізує з дією RONS, створюючи багаторівневу біоелектричну комунікацію, що координує регенерацію на рівні тканини.
Варто підкреслити, що дія Холодної плазми у вигляді технології іонізації газів підпорядковується феномену гормезису. Гормезис — це принцип, коли невелика доза стресора викликає компенсаторне посилення захисних систем. Клітина, реагуючи на короткий окисно-редукційний імпульс, активує:
- системи енергетичного балансу (AMPK, PGC-1α).
Таким чином, холодна плазма працює не як стимул пошкодження, а як тренувальний подразник, що «навчає» клітини залишатися функціонально молодими.
Інтегративна Концепція Довголіття від Plasma Skin
У підсумку, можна сформулювати єдину модель плазмового довголіття:
Контрольований плазмовий вплив → короткочасний редокс-стрес → активація систем очищення → оновлення мітохондрій і лізосом → оптимізація метаболізму → відновлення клітинного гомеостазу → підвищення тканинної стійкості → пролонгація молодості.
Цей ланцюг описує природний шлях саморегенерації, у якому плазма не «лікує» у класичному сенсі, а повертає клітині здатність до самоорганізації.